
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Решение. Изменение внутренней энергии газа: ΔU = сv mΔT = mΔT; (1)
Изменение внутренней энергии газа: ΔU = сv mΔT = 
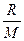 mΔT; (1)
mΔT; (1)
где i – число степеней свободы молекул газа (для двухатомных молекул кислорода i = 5); ΔT = Т3 – Т1 –разность температур газа в конечном (третьем) и начальном состояниях.
Начальную и конечную температуру газа найдем из уравнения Менделеева – Клапейрона рV =  , откуда: Т= рVМ /(mR).
, откуда: Т= рVМ /(mR).
Работа расширения газа при постоянном давлении выражается формулой:
А1 =  .
.
Работу газа, нагреваемого при постоянном объеме, равна нулю: А2 = 0.
Следовательно, полная работа, совершаемая газом: А = А1+ А2 = А1.
Согласно первому началу термодинамики, теплота Q, переданная газу, равна сумме изменения внутренней энергии ΔU и работа А: Q = ΔU + А.
Произведем вычисления, учтя, что для кислорода М = 32*10-3кг/моль (см. табл. 14 приложения):
Т1 =  К = 385 К;
К = 385 К;
Т2 =  К = 1155 К;
К = 1155 К;
Т3 =  К = 2887 К;
К = 2887 К;
А1 =  Дж = 0,400*106 Дж = 0,4 МДж;
Дж = 0,400*106 Дж = 0,4 МДж;
А = А1 = 0,4 МДж;
ΔU = 
 Дж = 3,24*106 Дж = 3,24 МДж;
Дж = 3,24*106 Дж = 3,24 МДж;
Q = (3,24 + 0,4) МДж = 3,64 МДж.

График процесса приведен на рис.7.
Дата добавления: 2015-02-10; просмотров: 287; Мы поможем в написании вашей работы!; Нарушение авторских прав |